美国FDA审核指南:建立AI医疗软件“预认证”,加速医疗软件上市审核
美国FDA尝试提出面向医疗人工智能产品的医疗器械独立软件预认证项目,旨在加速与简化医疗软件上市前的审核程序,为患者尽早带去新科技的便利和福音。
随着人工智能技术的不断进步,目前在医疗健康领域中,人工智能(Artificial Intelligence, AI)软件作为医疗器械,比重越来越大,也越来越广泛地应用于临床诊断与治疗,辅助医生决策和智能化患者信息管理。相比传统以硬件为主、软件为辅的嵌入式医疗器械软件,人工智能产品多以独立软件形式呈现,其便捷高效的应用显示出开发周期短、更新迭代快的特征,监管与审核都有异于传统硬件设备。
传统医疗器械软件监管体系主要针对嵌入式产品,审核周期长,缺乏适用于人工智能产品的审批经验和相关界定及标准,为人工智能产品上市落地带来极大影响和阻碍。针对此问题,美国FDA尝试提出面向医疗人工智能产品的医疗器械独立软件预认证项目,旨在加速与简化医疗软件上市前的审核程序,为患者尽早带去新科技的便利和福音。该项目的实施也为中国医疗器械独立软件监管的加速和完善带来借鉴和思考。
医疗行业长期存在医疗资源分配不均、医疗需求持续增长、医疗费用成本高,医生培养周期长等问题。人工智能新技术的发展为医疗领域现有问题带来解决方案,也逐渐成为改善就医环境、提升医疗服务水平的重要因素。虽然整体行业发展迅猛,但有一个问题一直制约其发展:医疗人工智能产品的审批。国家食品药品监督管理总局(CFDA)发布新版《医疗器械分类目录》中将医用软件辅助诊断进行风险界定,按二类、三类设置,大部分AI产品风险级别较高,属于第三类医疗器械。
目前为止,国内还没有一家公司的新一代医疗人工智能产品获得CFDA三类医疗器械注册证。该问题的原因主要来自两个方面:一方面是医疗人工智能产品作为全新产品,之前无审核该类产品的经验和标准数据库,相关界定并不完善;另一方面是难以明确人工智能诊断医疗责任主体。医疗人工智能产品不同于传统医疗器械,产品性能、算法模型等迭代更新快速,传统增项或升级审批的流程周期显然无法满足行业需求。
医疗人工智能产品属于新型医疗器械,独立开发且不倚赖于传统硬件设备,广泛应用于医疗健康的管理和监测,该类软件称为“独立软件”。《医疗器械监管条例(650号令)》中明确规定与健康医疗相关的独立软件是医疗器械的范畴。目前我国对医疗器械软件监管的主要依据有《关于医疗器械软件注册申报基本要求的说明》和《北京市医疗器械软件产品监督管理规定(暂行)》。前者仅限于提出对独立软件、软件组件等产品申报时的要求,并未涉及具体的安全、评测等规范;后者对北京市医疗器械软件产品的生产许可等事项做出明确规定,但并未对产品部分分类、质评、审核流程等做出更详细划分和说明。
2012年1月欧盟委员会出版文件MEDDEV 2.1/6,在医疗器械监管体系内指导性提出对独立软件进行鉴定和分类指南。美国针对该问题更明确提出打破传统医疗器械审批对医疗人工智能产品限制的方案。2017年7月,美国FDA发布数字健康创新行动计划(Digital Health Innovation Action Plan),FDA器械和放射健康中心(CDRH)计划通过开发医疗软件指南,改善数字医疗技术。在本次计划中,FDA针对医疗人工智能产品启动医疗器械独立软件预认证试点项目(Pre-Cert for Software Pilot Program),有望影响传统审评模式,基于客观质量标准,从软件设计、开发、验证以及企业组织、文化卓越程度上对企业进行预认证,加速软件在上市前的审核流程,最大程度加快软件技术革新在医疗行业的落地应用。本文对该预认证项目进行介绍和解读,为我国独立医疗软件监管提供借鉴和参考。
01.医疗器械软件定义和分类
根据美国FDA的定义,医疗器械软件是指任何符合医疗设备法律定义的软件,包括一个或多个软件组件、部件、附件或仅由软件组成的器械。中国则引用YY/T 0664-2008《医疗器械软件生存周期过程》中“旨在包括在被开发的医疗器械内的已开发的软件系统,或者预期本身用作医疗器械而开发的软件系统”。
医疗器械软件以其特殊性,从存在形式上分为两类:医疗器械嵌入式软件(Software In a Medical Device, SiMD)和医疗器械独立软件(Software As a Medical Device, SaMD)。医疗器械嵌入式软件是指传统以硬件设备为主的辅助式软件系统,例如监护仪中分析报警软件、呼吸机控制类软件等,广泛应用于医疗行业。独立软件作为医疗器械功能使用近年来层出不穷,例如辅助诊断疾病软件、影像档案传输处理系统等。国际医疗器械监管机构论坛(International Medical Device Regulators Forum, IMDRF)于2013年成立SaMD工作组,并明确定义“独立软件”为预期用于一个或多个医疗目的,无需作为医疗器械硬件组成部分即可完成预期用途的软件。
02.医疗器械独立软件监管进展
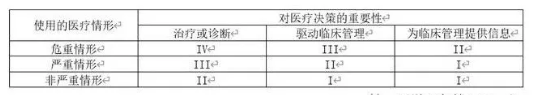
IMDRF目前已发布三份指南,分别是关于独立软件的关键定义(IMDRF/SaMD WG/N10FINAL:2013)、风险框架(IMDRF/SaMD WG/N12FINAL:2014)和质量管理体系(IMDRF/SaMD WG/N23 FINAL:2015)[9]。风险框架明确独立软件的分类因素、定义声明、风险框架和考量因素。基于对用户行动影响程度可分为治疗或诊断、驱动临床管理和为临床管理提供信息三大类;基于软件使用医疗情形可分为危重情形、严重情形和非严重情形。软件制造提供商将需根据上述分类出具软件定义声明,风险分类则基于上述两种维度分为四类(表1),其中I类为风险最低,IV类风险最高,风险类型越高将需受到越严格的风险控制措施。独立软件质量管理体系基于ISO 13485:2003《医疗器械质量管理体系用于法规的要求》制定,确定管理原则,包括领导和组织支持、生存周期支持过程、实现和使用过程。
表1 独立软件风险框架
03.美国FDA医疗器械独立软件预认证项目
传统FDA医疗器械监管指南主要针对医疗器械嵌入式软件(SiMD),随着大数据、机器学习、可穿戴产品、云计算等技术广泛应用,传统花费贵、耗时长的审评模式对医疗器械独立软件(SaMD)已不再适用。FDA提出针对此类产品的审评新标准,避免传统繁琐的审核流程。依据企业持续性生产高质量软件并能对其进行可靠测试、维护的能力做出评估,根据不同评估种类,可通过无审或精简审核后上市,极大程度加快高科技软件产品的应用和推广。该项目主要分为四个模块:预认证等级评估,审核路径确定,精简审核流程和真实世界实效性能监控。
预认证等级评估
认证范围
任何于美国正在开发或打算开发独立软件的企业或机构均可申请预认证。在此,待认证机构可以是独立企业,也可以是企业下属的一个业务单位。该预认证适用于不同规模、不同类型的机构。
评估机制
评估流程将致力于从待认证机构的产品质量、用户安全、临床可靠性、网络安全责任和前瞻性文化五个方面的卓越性进行考量。机构需从组织领导力、设计开发能力、风险管理等12个领域,细分49个元素展开详述并提供相关证明材料。质量评测参考现有的进行评估(QSR, ISO 13485, ISO 12207, ISO 62304, ISO 14971, ISO 9001)。除此之外,依据IMDRF发布的质量管理体系(IMDRF/SaMD WG/N23 FINAL:2015),从产品及组织文化的卓越性角度对机构进行评级,最终将分为以下两个等级:
等级一:允许组织机构在无审查情况下开发低风险软件,其他风险类型产品通过精简审查。(该级别认证将大大有利于在开发医疗软件上无经验或仅有限经验,但有能力提供高质量,安全有效产品的组织机构)。
等级二:允许组织机构在无审查情况下开发低风险和中度风险软件,其他风险类型产品通过精简审查。
审核路径确定
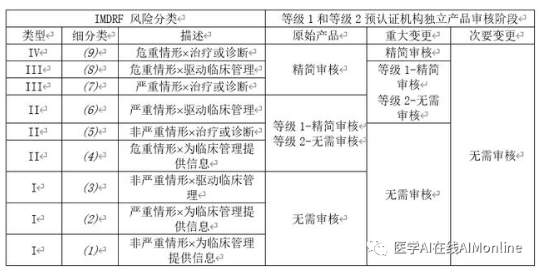
根据IMDRF发布的风险框架(IMDRF/SaMD WG/N12FINAL:2014),独立软件产品可分为四类(表1)。以该风险分类为基础,结合产品对医疗决策的重要性和使用的医疗情形两大特征,将产品风险细分为九大类,在不同阶段下,为不同评级的产品提供针对性的审核路径(表2)。例如:对于原始产品,在低风险情况下(Type I), 等级1认证与等级2认证机构均无需审核;在中等风险情况下(Type II),等级1认证机构需通过精简审核,等级2认证机构可通过无审核上市;在高风险情况下(Type III, Type IV),所有机构均需通过精简审核才可上市。
表 2 等级1和等级2预认证机构独立产品审核路径
精简审核流程
在完成待认证机构的卓越性评估,并确定审核路径后,一部分符合要求的产品可以无审核上市,另一部分,如上述工作模型所示,还需通过精简审核。精简审核致力于简化常规审核所需文件材料,机构需着重向FDA和公众证明其产品在安全性和有效性方面的杰出能力。
迭代精简审查
精简审核的核心模块是迭代式审查,强调交互式的早期参与。在机构提交初始的审核文件后,进入审核流程,在此期间,机构若有更新的补充材料和数据,仍可提交,同时也能申请得到FDA的反馈,及时修改审核文件。通过早期交互式的迭代,可节省批准审核流程所需时间。
简化的等价器械评估 510(k)文件
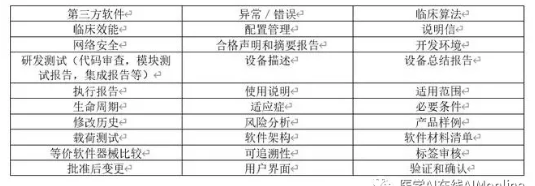
该文件是向FDA递交的上市前申请文件,目的是证明申请上市的产品与不受上市前批准影响的合法上市产品同样安全有效。在特殊情况下,例如外国制造进口商已由外国厂商递交510(k)并得到上市批准,则将不需重复递交510(k)文件。简化的510(k)比传统的申请更容易准备与审查,FDA总结了其中与独立软件相关的三十项重点考核元素以供参考(表3)。
表 3 软件相关510(k)文件重要审核元素
真实世界实效性能监控
在本次与认证中还有一个重要的考察模块,则是真实世界的数据分析,需要待认证机构不仅证明其强大的开发测试能力,还对实际应用情况进行评测,在模块一的卓越性评估报告材料中也需有所体现。真实世界数据不仅可用自身独立软件产品的评测数据,也可收集来自其他医疗健康的信息资源,例如国家卫生技术评价体系等(National Evaluation System for health Technology (NEST))。FDA预认证关心的真实世界效能分析主要在三个方向。
真实世界健康分析
该部分包括产品结果分析,人为因素和可用性工程分析,临床安全分析以及产品有效性分析。
用户体验分析
用户实际使用情况分析,包括用户满意度分析,解决方案,用户反馈渠道,用户参与度分析。
产品效能分析
产品效能包括产品结果的准确性,网络安全性,可靠性等分析。
04.小 结
综上所述,美国FDA针对医疗独立软件提出的预认证项目有以下三个特点:一是基于软件产品特征,全方位考虑产品设计、开发、测试、维护全流程的预认证评级,与传统医疗器械不同的是,预认证评级还将考虑企业文化、组织架构先进性和卓越性,对申请机构及产品本身的多角度考核;二是基于风险管理控制,产品根据应用场景和使用决策影响程度细分为不同风险类型,基于不同风险类型、不同认证评级采取不同的审核流程;三是根据软件生命周期的特点,简化该项目中产品上市前审核流程,为日新月异的软件新科技产品应用提供坚实的监管及审核支持。借鉴美国FDA对医疗器械独立软件的新监管措施,中国也应尽快适应新时代新形势,出台针对特殊性医疗软件产品的管理规范,填补该领域的监管缺失,以适应医疗健康行业的独立软件的快速稳进发展。
本文转载自其他网站,不代表大健康派观点和立场。如有内容和图片的著作权异议,请及时联系我们(邮箱:scarlet.s@djkpai.com)

关注大健康Pai 官方微信:djkpai我们将定期推送医健科技产业最新资讯



